無期限の休止をお知らせします。
本日をもちまして、無期限の休止をいたします。
今まで、ご愛読された方々や応援してくださった方々には心より感謝いたします。
なお、カイアシ類を取り上げた記事は以下のサイトにて、引き続き執筆していきますので、合わせて宜しくお願いします。
URL
2018年4月30日
カイアシ類の視力は、どのくらいあるのか。-魚を視認して逃げるカイアシ類-
カイアシ類は1mm程度の主に海洋を浮遊するプランクトンである。どうやらカイアシ類は周りの状況を眼で視認しているかもしれないというのだ。通常、カイアシ類ぐらいの大きさになると、眼に映像を写しだして脳で読み取る要になる網膜のサイズが限られてくるため、明るさを感じ取ることしかできない。これに対して、カイアシ類はどのようにして見ることができるのか。それはスキャンの方式でおこなわれているのではないか、と考察されてきている。
カイアシ類の眼は頭部の先端にあり、第一触角の付け根あたりに位置する。ノープリウス眼と呼ばれ、フジツボにもある(両者とも同じHexanauplia綱に属する)。単なる「単眼」と思われがちだが、ノープリウス眼は、側方各2つの部分と中心の1つの部分からなり(Mauchline 1998)、構造は複雑で、他の生物で見られる「単眼」とは区別をしたほうが良い。眼から出る神経は3つあり、ほぼ同位置にある大脳に接続している。

カイアシ類の眼の位置(筆者が撮影)
眼の「走査運動(scanning movement)」
さて、スキャンの方式で見るとはどういうことなのか。カイアシ類の眼にはいくつもの筋肉があり、この筋肉を使って眼を四方八方に動かしていることが分かっている(下動画)。この動きは1秒間に15回程度、遅くて1秒間に0.5~5回といった速さである(Gregory et al 1964;Wolken and Florida 1969)。それにちなんで「走査運動(scanning movement)」と称される(Yamaguchi and Okada 1972)。カイアシ類の眼の網膜上にある視細胞はとても少なく、5~8個しかない(Land 1988;Wolken and Florida 1969)。カイアシ類という大きさの都合上、この数が限界なのかもしれない。これでは当然、明るさを感じる程度の視力しかない。ここから物体を視認するにはどうすればいいのか。その鍵となるのは視野である。実は、視野がとても狭いことが解剖的に分かっている。それも、20°(Land 1988)、発達した眼をもつCopilia属は、なんと3°(Dowing 1972)しかない(!)。少ない視細胞に対して視野を狭くしているため、視精度が向上するということである。この視野が狭い眼を14°(Dowing 1972)あるいは45°(Land 1988)まで四方八方に動かしている。このようにして、明るさしか感じられない眼であっても、見るものの像をスキャンするようにして物体を視認できるレベルまで上げているという。
筆者が勝手ながら、Mass and Supin(1986)の公式を使って視力を計算したところ、「0.012程度」であった。ただ、魚類用につくられた公式なので信ぴょう性が低いということを伝えておく。

四方八方に高速で動くカイアシ類の眼(ごうぎしげる様Twitter@sgougiより許可を得て転載;https://twitter.com/sgougi/status/937103586252619776)
眼の走査運動はカイアシ類に限ることではなく、ハエトリグモにおいても知られている。ハエトリグモも視野は狭く、10°しかない。ヒトに匹敵する視力を得つつ、この眼を四方八方に動かして周りの状況を把握しているという。これについては過去に記事にしているので興味があったら参照して頂きたい。
カイアシ類の眼の特殊な例
カイアシ類の一部、CopiliaやCorycaeusは、尾を除く体長の半分近くある巨大な眼を持っていることが知られ、レンズを2つ持っているという。前方のレンズには望遠鏡の働きがあり、倍率は1.42程度ある(Wolken and Florida 1969)。これに加えて視野は3°しかないので、見るものの像は鮮明になる。神経は後方へ伸びているが、Uターンをして頭部にある脳に接続している。これらの種は他の生物に取り付く性質があり、視覚的に把握して取り付いているのかもしれない。

眼が発達したカイアシ類の一種Corycaeus sp. (ごうぎしげる様Twitter@sgougiより許可を得て編集し転載;https://twitter.com/sgougi/status/906085338581315584)
また、他のカイアシ類、PontellaやLabidocera(2種とも同じPontellidae科)も発達した眼を持っている。レンズの数は雄で3つ、雌で2つを持っている。海洋の界面付近に生息しており、太陽へ眼が向いている状態だという(Land 1988)。体を定位させる役割として働いていると考えられる。または、体内時計と関連しているのではないかと推測される。飼育実験で、光源を動かすと、それと同時に眼を追跡するように動かすことが観察されている。
Pontellaは他に魚などの視覚捕食者に対する対策としても眼が使われていることが知られている。何か物体が近づくと、秒速2mという素早い速さで逃避することが観察され、ときには水面をジャンプすることが知られる。これについては以前に記事にしているので、良かったら参照していただきたい。
文献
Downing, A. C. 1972. Optical scanning in the lateral eyes of the copepod Copilia. Perception 1: 193-207.
Gregory, R. L., Ross, H. E. and Moray, N. 1964. The curious eye of Copilia. Nature 201: 1166–1168.
Land, M. 1988. The functions of eye and body movement in Labidocera and other copepods. J. exp. Biol. 140: 381-391.
Mauchline, J. 1998. The biology of calanoid copepods. Academic Press. pp. 710.
Yamaguchi, T. and Okada, Y. 1972. Control of optokinetic response and orientation in Arthropod. JJME 10: 155-163.
Wolken, J. J. and Florida, R. G. 1969. The eye structure and optical system of the crustacean copepod, Copilia. J. Cell. Biol. 40: 279-85.
河川の生態系を支持する「河床間隙水域(hyporheic zone)」とは -間隙生態系とその多様性-
河川という環境は河川水と河床成分によって変動するものと捉えられてきているが、河川水が浸透されている河床間隙水域(hyporheic zone)が重要は働きがあると近年分かってきている。また、河床間隙水域中には表流水と比べ物にならない多様性があり、河床間隙水域中の生物相のみならず、多くの生物の生態において河床間隙水域は重要な存在意義があると言われている。
河床間隙水域(hyporheic zone)とは
河川の環境は大まかに流れのある表流水(surface water)と河床の深さ数十cm~1mの河床間隙水域(hyporheic zone)に分かれる(図1)。間隙(intertidal)とは粒状の堆積物で、積み重なる粒同士の間で生じる隙間のことを言う。河床間隙水域ではこの間隙が豊富にあるため、わずかながら間隙中に含まれる河川水の流れが生じている。そして表流水の流れによって、河床間隙水域と表流水の間で頻繁に河川水の出し入れが起きている。そのため、河床間隙水域中の微生物をはじめとする有機物や栄養塩類、溶存物資の行き来が盛んであり、その環境中の生物相の組成を変動させる要因になり得る(Boulton et al 1998)。

図1.河床間隙水域(hyporheic zone)の位置
河床間隙水域の物質循環としての意義
表流水中では生物が排便や死ぬなどとして、有機物が河床へ沈む。また流れてきた土壌や土砂も同様に沈む。河床間隙水域では、間隙が多く存在するため、ミクロな物質も効率よく補足する働きがある(Leichtfried 1991)。河床間隙水域では豊富なバクテリアが住んでおり(Chappuis 1942)、補足された物質を早い時間で分解する。したがって、河床間隙水域ではアンモニア化や硝化、脱窒といった有機物の分解が頻繁に起きている(Holmes et al. 1994、Holmes et al. 1996、Jones et al. 1995、Jones & Holmes 1996)。分解された物質は植物にとって有用なもので、光合成速度を加速させる(Boulton AJ et al 1998)。河床間隙水域から表流水へ流れでた物質は植物に利用され、食物連鎖へ受け渡され、迅速に物質循環が成り立つ。すなわち、河床へ沈降した有機物がそのまま留まることなく河床間隙水域で物質の分解、素早く物質が再利用されるという訳である。また、こうした循環によって水質浄化にもつながるという(Fiebig & Lock 1991)。
河床間隙水域の生物
河床間隙水域の間隙空間には多様な生物が住んでおり、これらの生物のことを「hyporheic zone(河床間隙水域)」からちなんで「hyporheos(以下、河床間隙生物)」と呼ばれている(「-os」は生物という意味がある;Orghidan 1959)。河床間隙生物(hyporheos)には微小の甲殻類やゴカイ、ミジンコ、ダニ、昆虫の幼虫などが含まれ、1mmに満たないメイオファウナで構成される。
メイオファウナ(meiofauna)とは肉眼では見えるか見えない位の大きさの動物相(ある場所の中に生息する全ての動物)のことで、0.031mm~1mmと定義されることがある(汎用される定義ではない)。これよりも小さい動物をマイクロファウナ(microfauna;鞭毛虫や繊毛虫)、さらに小さいものをナノファウナ(nanofauna;バクテリア)、ピコファウナ(picofauna;ウィルス)とよばれる(後2つは一般に使用される用語ではない)逆にメソファウナよりも大きいのをマクロファウナ(macrofauna;ヨコエビやゴカイ)と言う。マイクロとマクロは似た言葉だが、間違えないようにしてほしい。後述で「~ファウナ」という用語を使っていくので、ここで覚えていただきたい。
河床間隙生物の特徴として、形態が小さく、細長くなるというものがある。例としてカイアシ類(カイアシ類とは 2014年10月2日の記事 )について言うと、触角は短くなり、小型化、遊泳肢は少なく強化、付属肢の単純化があげられる(Galasii et al 2009;図2)。また、卵数が少なくなり、大きくなるという特徴もある(Reid 2001)。河床間隙水域という間隙環境に適応した形態変化と言える。

図2.カイアシ類における間隙性と浮遊性の形態差
河床間隙生物とバイオフィルムの関係
バイオフィルム(biofilm;菌膜)とはバクテリアが物質を分解した時に作られるもので、台所のヌメリや歯垢がバイオフィルムの一種である。バイオフィルム内ではバクテリアが大量に存在し、活動が活発になっている。いわばバイオフィルムはバクテリアの巣窟である。河床間隙生物はバイオフィルムが重要な食料源だと考えられており(Bärlocher & Murdoch 1989、Boulton 1999)、バイオフィルムの量が多いと河床間隙生物の活性が高まるという研究例もある(Montagna 1995)。したがって、河床へ沈殿した生物の糞や死骸といった有機物(デトリタス;detritus;以下から記述)を河床間隙生物が食べているというわけではなく、デトリタスを分解するバクテリアから生じたバイオフィルムを河床間隙生物が食べているということになる。これはメイオファウナ以下の動物相で見られるもので、マクロファウナはバイオフィルムではなくデトリタスそのものを食べている。これらは共通してデトリタス食生物(腐食生物)と呼ばれるが(Leduc & Probert 2009)、その食性はメイオファウナとマクロファウナで異なる。
河床間隙水域の生態系と食物連鎖
河床間隙水域には多様な生物が存在するが、組成で見ると線形動物(線虫など)の生物量が一番多く、次いでカイアシ類(とくにハルパクチクス目;図2の間隙性カイアシ類があたる)が多い(Hicks & Coull 1983)。このカイアシ類は間隙環境に適応した種で、一般に呼ばれる浮遊性と区別するため、間隙性カイアシ類と呼んでいく。間隙性カイアシ類は間隙環境で成立する食物連鎖から、高次の栄養段階である子稚魚へ栄養を渡すという重要な位置にある(Kaczynski et al 1973、Sibert et al 1977、Hicks & Coull 1983)。また、1立法cmあたりの間隙中に10~100個体と高密度に生息していることから(Boxshall & Halsey 2004)その貢献力は高い。
この間隙性カイアシ類はメイオファウナのひとつになるが、前述のとおり、他のメイオファウナと同様、デトリタスに発生するバイオフィルムが重要な食料源になっている(Gonzalez et al 2004)。また、間隙中の珪藻類も多く食べることが分かっている(Buffan-Duban et al 1996)。つまり、カイアシ類は草食性とデトリタス食性の2つの食性をもつということになる。
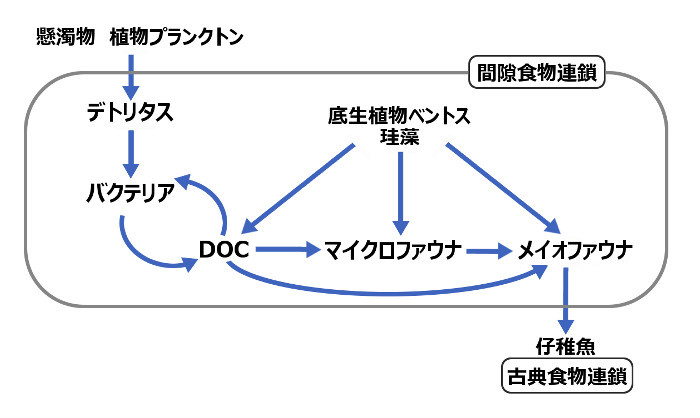
食物連鎖とは、連鎖的に小さい生物から大きな生物へ栄養が受け渡される鎖のような関係とよく述べられるが、近年、この食物連鎖は単に小さい生物から大きな生物へと単純なものではないと分かっている。ひとつに微生物環(micro bial loop;詳細は 2015年11月5日の記事 )がある。これはバクテリア間で起きているもので、水中に溶け込んでいる有機炭素を分解、バクテリアが再利用というミクロな食物連鎖である(lower food webとも呼ばれる)。他にも海底や間隙中といった特定の環境内のみに成り立つ食物連鎖があり、従来に言われていた食物連鎖よりも複雑化している。したがって、プランクトンから小魚へ中型の魚、大型の魚とよく述べられる食物連鎖のことを古典食物連鎖(classic food chain)と俗に呼ばれるようになっている(Cnudde 2013)。ここでも古典食物連鎖を使っていく。
間隙中で成立する食物連鎖は、河床へ沈殿した生物の死骸や糞といった懸濁物や植物プランクトンからはじまる。これらはデトリタスとして間隙中へ取り込まれるが、バクテリアによって分解される。これによってバイオフィルムの形成や水中へ有機炭素が溶けこむ(以降、DOC(dissolved organic carbon);溶存有機炭素)。このDOCはマイクロファウナ(鞭毛虫や繊毛虫)やメイオファウナ(とくに間隙性カイアシ類)によって摂餌される。実は、バクテリアとメイオファウナがつながることは容易なものではなく、普段はそれぞれが確立されている。これが繋がった要因として、バクテリアがバイオフィルムを形成することがあげられ、これによってエネルギー流動(バクテリアのエネルギーが容易に高次へ渡されること)を効率化していると言われる(Schmit et al 1998)。間隙カイアシ類は他にも珪藻を含めるマイクロファウナも摂餌する(Buffan-Duban et al 1996)。ここまでが間隙食物連鎖である。そして、間隙性カイアシ類は子稚魚に食べられ、子稚魚からはじまる古典食物連鎖へつながる(図3)。すなわち、間隙食物連鎖は閉鎖的な栄養循環であったが、間隙性カイアシ類の存在によって、容易に古典食物連鎖へリンクし、間隙性カイアシ類が重要な位置づけと言えるというわけである。
河床間隙水域の保全
河床間隙水域について、その仕組みや意義を理解し、河床間隙水域を取り巻く生態系の重要性について知ってもらえたと思う。その他にも無脊椎動物の産卵場として、卵や蛹、休眠個体を保護し安定した環境を与え、順調な生産をおこなえるという役割もあり(Boulton et al 1998)、河床に産卵するサケなどの魚類についても同様に言える(Coble 1961)。また、洪水や捕食圧、干ばつ、表流水の水質悪化などの避難場としても機能する(Boulton 1993、Dole-Oliver M-J et al 1997)。述べていくと切りがないほど、河床間隙水域の意義や重要性は無数にある。しかしながら、近年の都市開発によって、河床間隙水域は破壊されつつある。河川開発(堤防や河川脇の開拓など)による減少や、都市からの排水中にある微細な粒子による間隙の目詰りなど、影響は多い(Boulton et al 1998)。このようなものは、河床間隙水域の環境を悪化し、河床間隙生物は住めなくなってしまう。すなわち、上記に上げた河床間隙水域の意義や重要性で上げた一例が妨げることになり、その生態系は崩れてしまうというわけである(種の衰退や絶滅も含む)。今後は河床間隙水域の保全を考えていくことも取り巻く生態系を考えていく上で必要と言える。
文献
Bärlocher F, Murdoch LH. 1989. Hyporheic biofilms- a potential food source for intertidal animals. Hydrobiologia 184: 61-67.
Boulton AJ. 1993. Stream ecology and surface-hyporheic exchange: implications, techniques and limitations. Aust. J. Mar. Freshwat. Res. 44: 553-564.
Boulton AJ, Findlay S, Marmonier P, Stanley EH, Valett HM. 1998. The functional significance of the hyporheic zone in streams and rivers. Annu. Rev. Ecol. Syst. 29: 59-81.
Boulton AJ. 1999. The ecology of subsurface macrofauna. See. Ref. 77.
Buffan-Dubau E, de Wit R, Castal J. 1996. Feeding selectivity of the harpacticoid copepod Canuella perplexa in benthic muddy environments demonstrated by HPLC analyses of chlorin and carotenoid pigments. Mar. Eco. Prog. Ser. 137: 71-82.
Chappuis PA. 1942. Eine neue methode zur untersuchung der grundwasser fauna. Microb. Ecol. 34: 49-57.
Boxshall GA, Halsey SH. 2004. An introduction to copepod diversity. Vol 1. Ray Society.
Cnudde C. 2013. Trophic ecology of intertidal harpacticoid copepods, with emphasis on their interactions with bacteria. Ghent University.
Coble DW. 1961. Influence of water exchange and dissolved oxygen in redds on survival of steelhead trout embyos. Trans. Am. Fish. Soc. 90: 469-474.
Dole-Oliver M-J, Marmonier P, Beffy J-L. 1997. Response of interbrates to lotic disturbance: Is the hyporheic zone a pathy refugium? Freshwat. Biol. 37: 257-276.
Fiebig DM, Lock MA. 1991. Immobilization of dissolved organic matter from ground water discharging through the stream bed. Freshwat. Biol. 26: 45-55.
Galassi DMP, Huys R, Reid JW. 2009. Diversity, ecology and evolution of ground water copepods. Freshwat. Biol. 54: 691-708.
Gonzalez CA, Pavez A, Iriarte J, Santibanez P, Castrol L, Escribano R, Pages F. 2004. Carbon cycling through the pelagic food web in the Northern Humboldt Current off Chile (23 degree S). Ice. J. Mar. Sci. 61: 572-582.
Hicks GFR, Coull BC. 1983. The ecology of marine meiobenthic harpacticoid copepods. Oceanogr. Mar. Biol. 21: 67-175.
Holmes RM, Fisher SG, Grimm NB. 1994. Parafluvial nitrogen dynamics in a desert stream ecosystem. J. N. Am. Bemthol. Soc. 13: 468-478.
Holmes RM, Jones JB, Fisher SG, Grimm NB. 1996. Denitrification in a nitrogen-limited ecosystem. Biogeochemistry 33: 125-146.
Jones JB, Fisher SG, Grimm NB. 1995. Nitrification in the hyporheic zone of a desert stream ecosystem. J. N. Am. Benthol. Soc. 14: 249-258.
Jomes JB, Holmes RM. 1996. Surface-subsurface interaction in stream ecosystems. Trends. Ecol. Evol. 11: 239-242.
Kaczynski VW, Feller RJ, Clayton J, Gerke RJ. 1973. Tropic analysis of juvenile pink and chum salmon (Oncorhynchus gorbuscha and O. keta) in puget sound. J. Fish. Res. BdCan. 30: 1003-1008.
Leduc D, Probert PK. 2009. The effect of bacterivorous nematodes on detritus incorporation by macrofaunal detrivores: A study using stable isotope and fatty acid analysis. J. Exp. Mar. Biol. Ecol. 371: 130-139.
Leichtfried M. 1991. POM inbed sediments of a gravel stream (Ritrodat-Lunz Stady Area, Austria). Verh. Int. Ver. Limnol. 24: 1921-1925.
Montagna PA. 1995. Rates of metazoan meiofaunal microbivory: a review. Vie Milieu 45: 1-9.
Orghidan T. 1959. Ein neuer lebensraum des unterirdischen wassers: der hyporheische biotop. Arch. Hydrobiol. 55: 392-414.
Reid JW. 2001. A human challeng: discovering and understanding continental copepod habitats. Hydrobiologia 453/454: 201-226.
Schmit JL, Deming JW, Jumars PA, Keil RG. 1998. Constancy of bacterial abundance in surficial marine sediments. Limnol. Oceangr. 43: 976-982.
Sibert J, Brown TJ, Healey MC, Kask BA, Naiman RJ. 1977. Detritus-based food web: exploitation by juvenile chum salmon (Oncornchus keta). Science. N. Y. 196: 649-650.